Para entendermos as Funções inorgânicas, à priori é fundamental compreender quimicamente o significado do termo função. As funções químicas são grupos de substâncias compostas que apresentam propriedades químicas em comum. Temos dois grandes grupos de funções químicas: as orgânicas e as inorgânicas. A primeira tem relação com as que permeiam a química do carbono, será uma abordagem para um momento futuro. Já a segunda será o tema discutido aqui. Existem quatro grandes grupos inorgânicos: Os óxidos, os ácidos, as bases e os sais.
Óxidos
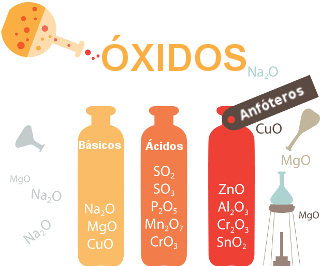
São compostos binários que apresentam necessariamente o oxigênio, e este tem que ser o átomo mais eletronegativo do composto. Assim, qualquer composto formado por apenas flúor e oxigênio não é um óxido, mas sim um sal. Existem alguns tipos de óxidos, dentre esses os Anidridos são óxidos com característica ácida, ou seja, quando este óxido reage com água, formamos um ácido. Temos como exemplos de Anidridos o SO2,CO2 e N2O5. Já os óxidos básicos, tem uma característica que condiz com o próprio nome: formar uma base ao reagir com a água, temos como exemplo o NaO, CaO, FeO e entre outros. Enquanto isso, os óxidos anfóteros, como o ZnO, possuem características tanto ácidas quanto básicas, e os óxidos neutros (H2O, NO, CO e N2O) não possuem nenhuma dessas características. De modo geral, o oxigênio nessa função apresenta um número de oxidação igual a 2-, com exceção dos peróxidos, como o H2O2, e nos superóxidos, como o KO2, onde o átomo em questão apresenta, respectivamente, nox 1- e ½-.
Ácidos

Existem algumas definições para o que seria um ácido, estas passam por Arrhenius, Bronsted-Lowry e Lewis. Usemos aqui a de Arrhenius, a mais simples das três. Segundo o químico sueco, ácido se define como qualquer molécula que, em meio aquoso, libera H+. Existem de, modo geral, dois tipos de ácidos: os hidrácidos, que são formados apenas por hidrogênio e um outro átomo, como HCl, H2S, HBr, e os óxiácidos, que apresentam também oxigênio na molécula, como H2SO4, HNO3, H2CO3.
A classificação pelo nível de força de um ácido depende do tipo do mesmo, caso seja um hidrácido, é tido como forte o HCl, HBr e HI. Já HF como moderado e os outros como fracos. Caso seja um oxiácido, é tido como forte os que tiverem a diferença entre número de oxigênios e hidrogênios dentro da molécula maior ou igual a 2, como o H2SO4, moderado se for igual a 1, HNO2, e se for menor que 1, fraco, como o HClO.
Bases
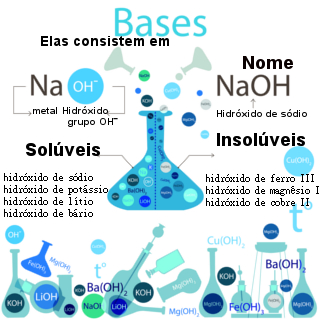
Levando aqui em consideração também as definições de Arrhenius, base é qualquer composto que, quando em solução aquosa, libera íons OH–. NaOH, Mg(OH)2, KOH, Fe(OH)2 são todas substâncias tidas como base. Para qualificar segundo a força, apenas tendo conhecimento dos casos: Bases de metais da família 1A e 2A são fortes, com exceção do Mg, Cs e Be, que são fracas, assim como a de todos os outros.
Sais
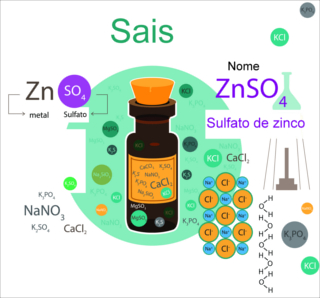
São compostos iônicos formados por uma reação de neutralização, esta ocorre sempre entre um ácido e uma base, formando sempre um sal e água. Determinados sais apresentam uma certa característica ácida ou alcalina (básica) dependendo do ácido e da base que o tenha dado origem. Caso tenha vindo um ácido forte e uma base fraca terá um caráter ácido, como o MgCl2, de uma base forte e um ácido fraco terá caráter básico, como o NaCN, enquanto provindo de uma base forte com um ácido forte, ou uma base fraca com um ácido fraco, o caráter vai ser majoritariamente neutro.
 Ansioso para aprender mais sobre química? Fique ligado pois estaremos transmitindo uma aula ao vivo totalmente gratuita de Funções Inorgânicas do nosso curso Foca na Medicina. Lá você vai ver de verdade como a química é trabalhada no vestibular.
Ansioso para aprender mais sobre química? Fique ligado pois estaremos transmitindo uma aula ao vivo totalmente gratuita de Funções Inorgânicas do nosso curso Foca na Medicina. Lá você vai ver de verdade como a química é trabalhada no vestibular.







