Os gases são fluidos que apresentam deslocamento livre das partículas que os constituem, ou seja, quando colocados em um recipiente possuem a capacidade de ocupa-lo por completo. Além disso, os gases são elementos químicos que não apresentam valores como volume, densidade e forma definidos, fazendo com que as suas propriedades sejam sempre variáveis.
Alguns fatos sobre os gases:
- Os gases são compostos de moléculas ou de átomos.
- O estado gasoso é um dos três estados físicos da matéria.
- O ar que respiramos é constituído, em sua maior parte, pelo gás nitrogênio (N2) e de gás oxigênio (O2).
- Os únicos gases formados somente por átomos são os gases nobres, pertencentes à família 18 da tabela periódica.
Os gases ideais
Os gases ideais são definidos como aqueles em que a colisão entre os átomos e moléculas são completamente elásticos, ou seja, a quantidade de movimento é conservada nessas condições. Além disso, um gás ideal não irá apresentar atração e nem repulsão entre as suas moléculas.

Lei geral dos gases perfeitos
Na natureza, os gases ideais não são facilmente encontrados, pois são apenas um modelo idealizado por químicos. Entretanto, no Enem e em outros vestibulares, é muito comum encontrar exercícios que envolvam os gases perfeitos. A expressão que determina a lei geral dos gases perfeitos é essa:
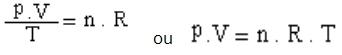
Onde:
P = Pressão | V = Volume | n = Número de mols | R = Constante Universal dos Gases Perfeitos | T = Temperatura
Curiosidade: a lei dos gases perfeitos ou Equação de Clapeyron é a junção das três principais leis dos gases, que iremos falar mais a frente.
Entendendo as propriedades
Pressão: a pressão é a somatória das forças exercidas pelas moléculas de um gás durante a colisão entre elas e com a parede do recipiente em que estão contidas.
Temperatura: estado térmico das partículas de um gás.
Volume: espaço ocupado por um gás em um determinado recipiente.
Constante Universal dos Gases: constante física que relaciona a quantidade de um gás com a pressão e temperatura. Normalmente representada pelo valor 8,31.
Número de mols: relação entre a massa m do gás (expressa em gramas) e a massa molar M.
Lei de Boyle
De acordo com a Lei de Boyle, todo gás contido em um sistema fechado, ou seja, em que sua temperatura se mantém constante, terá a sua pressão inversamente proporcional ao volume ocupado no recipiente. Matematicamente falando…
Po.Vo= P.V
Onde p0 e V0 são respectivamente a pressão inicial e o volume inicial.
Lei de Charles
Esta lei mostra que a pressão de um gás é diretamente proporcional à sua temperatura absoluta quando o volume é constante. Matematicamente falando…
Po/To = P/T
Onde p0 e T0 são respectivamente a pressão inicial e o temperatura inicial.
Lei de Gay-Lussac
A terceira e última lei dos gases diz que em uma transformação isobárica, onde a pressão é constante, a temperatura e o volume são grandezas diretamente proporcionais. Ou seja…
Vo/To = V/T
Onde Vo e e To são respectivamente o volume inicial e temperatura inicial.
 Quer saber mais sobre os gases e outros assuntos relacionados à Física para mandar bem no Enem 2017? Não deixe de conferir o nosso curso:
Quer saber mais sobre os gases e outros assuntos relacionados à Física para mandar bem no Enem 2017? Não deixe de conferir o nosso curso:
🚀 Física do Zero 🚀
Mande a sua nota baixa para o espaço, é só clicar aqui.
Acesse: www.enem.com.br







