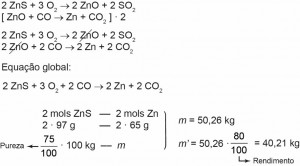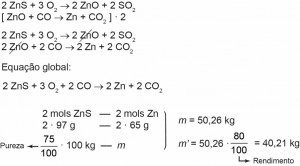Ano após ano, o Enem (Exame Nacional do Ensino Médio) vem elevando o nível das questões. Com relação a química não é diferente. As questões são abordadas de forma contextualizada com o cotidiano e de forma interdisciplinar, exigindo das estudantes respostas às questões propostas para além de fórmulas e conceitos, privilegiando a aplicação dos conteúdos na resolução dos problemas de forma diferenciada. Como muitos temas em química estão conectados entre si é necessário que os estudantes estejam por dentro de aspectos e conceitos químicos. Veja agora as 5 questões mais difíceis de química do Enem 2015.
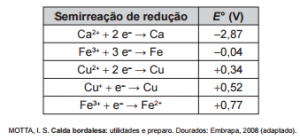
1.(Enem 2015) A calda bordalesa é uma alternativa empregada no combate a doenças que afetam folhas de plantas. Sua produção consiste na mistura de uma solução aquosa de sulfato de cobre (II), CuSO4, com óxido de cálcio, CaO, e sua aplicação só deve ser realizada se estiver levemente básica. A avaliação rudimentar da basicidade dessa solução é realizada pela adição de três gotas sobre uma faca de ferro limpa. Após três minutos, caso surja uma mancha avermelhada no local da aplicação, afirma-se que a calda bordalesa ainda não está com a basicidade necessária. O quadro apresenta os valores de potenciais padrão de redução (E°) para algumas semirreações de redução.
A equação química que representa a reação de formação da mancha avermelhada é:
a) Ca2+ (aq) + 2 Cu+ (aq) –> Ca (s) + 2 Cu2+ (aq).
b) Ca2+ (aq) + 2 Fe2+ (aq) –> Ca (s) + 2 Fe3+ (aq).
c) Cu2+ (aq) + 2 Fe2+ (aq) –> Cu (s) + 2 Fe3+ (aq).
d) 3 Ca2+ (aq) + 2 Fe (s) –> 3 Ca (s) + 2 Fe3+ (aq).
e) 3 Cu2+ (aq) + 2 Fe (s) –> 3 Cu (s) + 2 Fe3+ (aq).
Comentário:
O potencial indica a tendência de uma transformação acontecer.
A questão fornece uma série de potenciais de redução. Logo, a simples conferência dos potenciais, indica qual reação ocorre na verdade.
Assim:
×3 [Cu+2(aq) + 2 e– → Cu0(s) ] E0 = +0,34 V
×2 [Fe0(s) → Fe+3(aq) + 3 e–] E0 = +0,04 V
______________________________________
3 Cu+2(aq) + 2 Fe (s) → 3 Cu0(s) + 2 Fe+3(aq)
Atente para o fato do potencial de redução do Cu2+ ser maior que o do Fe3+.
Gabarito: e
- (Enem 2015)
A bomba
reduz neutros e neutrinos, e abana-se com o leque da reação em cadeia
ANDRADE, C. D. Poesia completa e prosa. Rio de Janeiro: Aguilar, 1973 (fragmento).
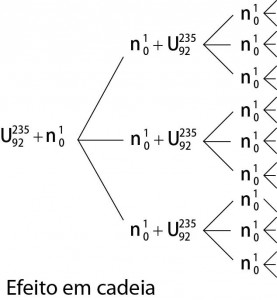
Nesse fragmento de poema, o autor refere-se à bomba atômica de urânio. Essa reação é dita “em cadeia” porque na
a) fissão do 235U ocorre liberação de grande quantidade de calor, que dá continuidade à reação.
b) fissão do 235U ocorre liberação de energia, que vai desintegrando o isótopo 238U, enriquecendo-o em mais 235
c) fissão do 235U ocorre uma liberação de nêutrons, que bombardearão outros núcleos.
d) fusão do 235U com 238U ocorre formação de neutrino, que bombardeará outros núcleos radioativos.
e) fusão do 235U com 238U ocorre formação de outros elementos radioativos mais pesados, que desencadeiam novos processos de fusão.
Comentário:
A fissão nuclear é também conhecida como reação em cadeia.
Exemplo:
A produção de novos nêutrons acarretará novo bombardeio que a cada etapa de produção atingirá novos 3 átomos de urânio, segundo o esquema.
Gabarito: c
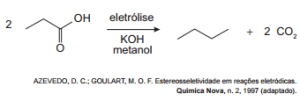
3 (Enem 2015) Hidrocarbonetos podem ser obtidos em laboratório por descarboxilação oxidativa anódica, processo conhecido como eletrossíntese de Kolbe. Essa reação é utilizada na síntese de hidrocarbonetos diversos, a partir de óleos vegetais, os quais podem ser empregados como fontes alternativas de energia, em substituição aos hidrocarbonetos fósseis. O esquema ilustra simplificadamente esse processo.
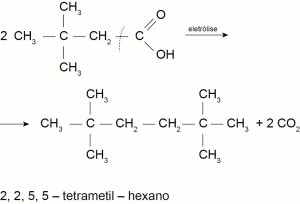
Com base nesse processo, o hidrocarboneto produzido na eletrólise do ácido 3,3-dimetil-butanoico é o
a) 2,2,7,7-tetrametil-octano.
b) 3,3,4,4-tetrametil-hexano.
c) 2,2,5,5-tetrametil-hexano.
d) 3,3,6,6-tetrametil-octano.
e) 2,2,4,4-tetrametil-hexano.
Comentário:
Gabarito: c
4 (Enem 2015) Para proteger estruturas de aço da corrosão, a indústria utiliza uma técnica chamada galvanização. Um metal bastante utilizado nesse processo é o zinco, que pode ser obtido a partir de um minério denominado esfalerita (ZnS), de pureza 75%. Considere que a conversão do minério em zinco metálico tem rendimento de 80% nesta sequência de equações químicas:
2 ZnS + 3 O2 –> 2 ZnO + 2 SO2
ZnO + CO –> Zn + CO2
Considere as massas molares: ZnS (97 g/mol); O2 (32 g/mol); ZnO (81 g/mol); SO2 (64 g/mol); CO (28 g/mol); CO2 (44 g/mol); e Zn (65 g/mol).
Que valor mais próximo de massa de zinco metálico, em quilogramas, será produzido a partir de 100 kg de esfalerita?
a) 25
b) 33
c) 40
d) 50
e) 54
Comentário:
Gabarito: c
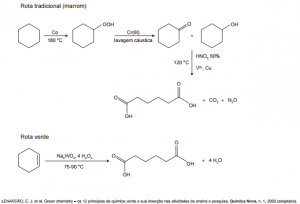
5 (Enem 2015) A química verde permite o desenvolvimento tecnológico com danos reduzidos ao meio ambiente, e encontrar rotas limpas tem sido um grande desafio. Considere duas rotas diferentes utilizadas para a obtenção de ácido adípico, um insumo muito importante para a indústria têxtil e de plastificantes.
Que fator contribui positivamente para que a segunda rota de síntese seja verde em comparação à primeira?
a) Etapa única na síntese.
b) Obtenção do produto puro.
c) Ausência de reagentes oxidantes.
d) Ausência de elementos metálicos no processo
e) Gasto de energia nulo na separação do produto.
Comentário:
Um dos princípios da química verde defende que as reações que se processam com menor número de etapas são ambientalmente mais interessantes, pelo fato de gerarem menos resíduos.
Gabarito: a